
Leonardo Bello, Maibi Apaclia, Ricardo Raúl Forastiero. MANLAB, Sector Hematología / Hemostasia.
El diagnóstico de laboratorio del síndrome antifosfolípido (SAF) requiere la determinación de la actividad de anticoagulante lúpico (AL) por ensayos de coagulación y de anticuerpos anticardiolipina y anti-β2-glicoproteina I por ensayos en fase sólida (1). La detección de AL está basada en ensayos
coagulantes dependientes de fosfolípidos (FL). A pesar de los años transcurridos el diagnóstico siempre resulta complejo y requiere de métodos de coagulación bien establecidos, puntos de corte adecuadamente obtenidos y de criterio profesional para la interpretación de los resultados. Entre otras complicaciones está la evaluación en pacientes con terapia anticoagulante con heparina, anti-vitamina K y los más recientes antitrombóticos directos (DOACs anti-Factor Xa y anti-trombina).
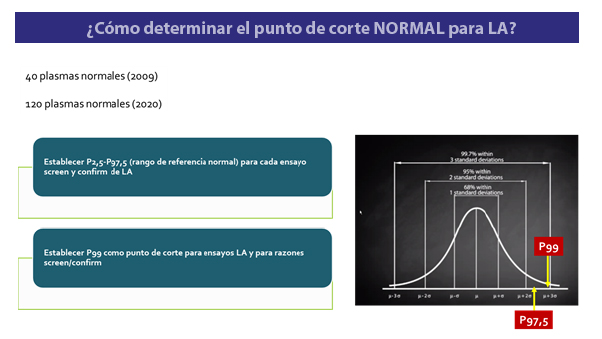 Figura 1. Pautas para establecer los puntos de corte normal en los ensayos para AL
Figura 1. Pautas para establecer los puntos de corte normal en los ensayos para AL
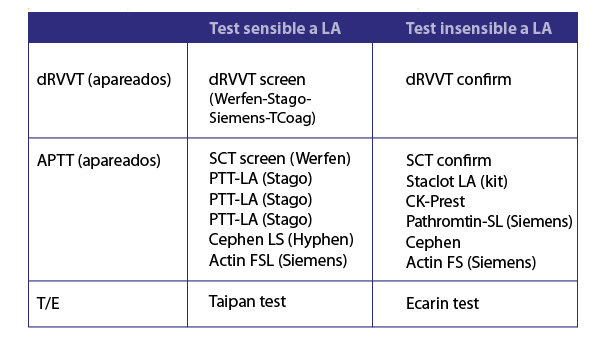 Figura 2. Ensayos y combinaciones utilizados en el diagnostico de AL en 2023
Figura 2. Ensayos y combinaciones utilizados en el diagnostico de AL en 2023
Recomendaciones en guías internacionales
Las ultimas guías publicadas por el Comité científico de estandarización (SSC) de la Sociedad Internacional de Hemostasia y Trombosis (ISTH) fueron de 2020 (2). Contienen una serie de recomendaciones que deben seguir los laboratorios que realicen la prestación de AL. Respecto a los ensayos a realizar se incluye un perfil de ensayos de rutina (tiempo de protrombina, APTT estándar y tiempo de trombina) para conocer el estado basal del paciente. Además, dos tipos de ensayos específicos para LA basados en principios diferentes: dRVVT (tiempo de veneno de víbora Russell diluido) y APTT sensible. El APTT preferentemente debe contener sílice como activador. La prolongación en los dos tipos de ensayos debe establecerse cuando el valor obtenido supera el punto de corte establecido localmente en cada laboratorio evaluando plasmas normales. Se complementa con ensayos de mezcla con plasma normal y con ensayos confirmatorios. Una de las interpretaciones se basa en el cálculo (normalizado o no) de la razón del ensayo de detección/ensayo de confirmación.
El mismo es considerado positivo si esa razón es mayor al percentil 99 de la distribución normal.
Los puntos de corte se deben establecer realizando en varios días, plasmas normales, y la recomendación es usar 100-120 plasmas de individuos aparentemente normales (3). Los rangos de referencia de normalidad de cada ensayo se deben establecer entre el percentil 2.5 y el 97.5. En cambio, el punto de corte del percentil 99 de la distribución se sugiere como el recomendado para establecer que un ensayo es positivo cuando es mayor el resultado obtenido que el P99 (Figura 1). Esto se aplica tanto a los ensayos individuales como a las razones utilizadas (ejemplo: screen/confirm, mezcla paciente+normal/normal, etc).
Algo importante es excluir los outliers (valores en los extremos de la distribución normal) antes de establecer los puntos de corte normal (2). Para ello se sugiere usar el método de Reed que básicamente se refiere a la exclusión del resultado más prolongado (en el caso de ensayos de AL).
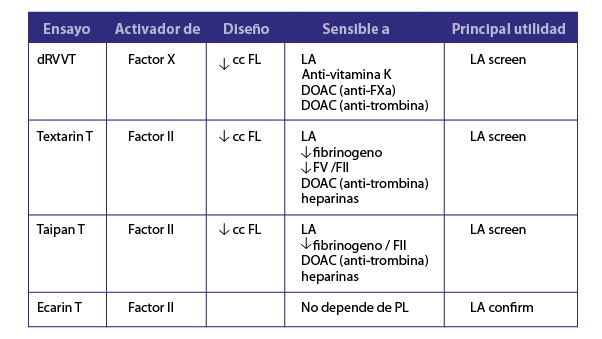 Figura 3. Características de los principales venenos de víbora utilizados en el diagnóstico del AL
Figura 3. Características de los principales venenos de víbora utilizados en el diagnóstico del AL
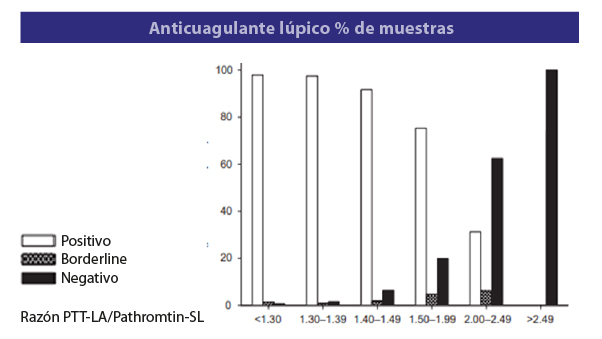 Figura 4. Porcentaje de pacientes del grupo de 1553 pacientes con resultados negativos o positivos de acuerdo con el valor de la razón PTT-LA/Pathromtin-SL
Figura 4. Porcentaje de pacientes del grupo de 1553 pacientes con resultados negativos o positivos de acuerdo con el valor de la razón PTT-LA/Pathromtin-SL
Ensayos de laboratorio para el diagnóstico del AL
Los métodos recomendados para la detección o screning quedaron restringidos a dos tipos: dRVVT y APTT con baja concentración de FL. Esta combinación tiene un alto % de posibilidad de detectar al AL si está presente. Algo importante es el tipo de activador del APTT porque sílice es el único recomendado. El ácido elágico muestra una cierta sensibilidad, pero menor que la del sílice. Otro ensayo comercial de amplio uso en el mundo es el silica clotting time (SCT) que es básicamente un APTT (Figura 2). Hay otros ensayos que no se recomiendan por diferentes motivos: variabilidad en la sensibilidad de los reactivos (tiempo de protrombina con tromboplastina diluida), poca reproducibilidad (tiempo de coagulación con
caolín) o la imposibilidad de conseguirlos comercialmente (tiempo textarin/ecarin) (4). Un ensayo recientemente validado para el estudio del AL está basado en dos venenos de víbora que activan directamente protrombina o factor II de coagulación (5). Ellos son el Taipan con sensibilidad a FL pero que no es afectada en pacientes con anti-vitamina K o DOACs anti-FXa. El Ecarin es insensible a la presencia de FL y seria la prueba confirmatoria (Figura 2). Lamentablemente estos reactivos no se pueden conseguir aun en Latinoamérica. En la Figura 3 podemos ver un resumen de los distintos venenos de víbora y los ensayos que se usan para diagnosticar el AL.
APTT apareados
El APTT es una prueba de rutina que permite la detección de deficiencias de factores de la vía intrínseca de la coagulación, heparina, inhibidores adquiridos de la coagulación tanto con tendencia clínica hemorrágica (ej: inhibidor anti-FVIII) como trombótica (AL). Obviamente que la sensibilidad a estas alteraciones no es igual en todos los reactivos comerciales porque básicamente difieren en el tipo de activador y la composición de FL.
Una de las primeras publicaciones que recomienda un ensayo simple de detección y confirmación está basado en la publicación de 1997 (6). Ellos usaron un reactivo con cefalina de conejo y activador caolín como APTT sensible al AL y Actin FS que contiene FL de origen vegetal como APTT insensible al AL. La razón entre el APTT sensible y el insensible demostró ser útil para detectar al inhibidor de tipo lúpico, dando normal la misma en pacientes con heparina y otras alteraciones hemostáticas que prolongan el APTT. En 23 pacientes con AL, 22 dieron razones APTT sensible/APTT insensible positivas (media 2.08). en general observaron que con el APTT insensible se obtenían resultados que eran la mitad en segundos que los obtenidos con el APTT sensible. En pacientes con deficiencias de factores o inhibidores anti-FVIII las razones eran cercanas a 1.0 porque las prolongaciones eran proporcionales con ambos reactivos.
En otro trabajo más reciente se compararon los reactivos de APTT Cephen LS y Cephen (7). La razón Cephen LS/Cephen mostro datos positivos en 33 de 105 muestras previamente clasificados como AL positivos y 31 de ellos dieron también positivos en la razón usando dRVVT (detección y confirmación). Sin embargo, esta combinación de reactivos dio menor sensibilidad que la obtenida previamente con la razón dRVVT y PTT-LA cómo APTT sensible.
En 2016 se publicó un estudio realizado por 4 años en un centro pediátrico donde detectaron 161 pacientes con APTT prolongado y confirmado en una
una segunda muestra (8). En la rutina utilizaron Platelin LS por su versatilidad para detectar deficiencias de factores y también la presencia de AL. Como APTT confirmatorio usaron un reactivo insensible al AL como el Actin FS. La presencia de AL fue demostrada en 64/88 (73%). Platelin LS (con sílice) fue prolongado en ese grupo de pacientes y solo 4 pacientes tuvieron prolongación de los 64 con Actin FS. El punto de corte establecido fue de 1.29 y la razón Platelin LS/Actin FS tuvo una significación estadística con AL (p<0.05). Usando este par de APTTs la sensibilidad para detectar AL aumento a 82-86%.
En Suiza realizaron un estudio para verificar si la utilización de una razón APTT sensible/APTT insensible a AL podría resultar una herramienta útil en el estudio del AL (9). Incluyeron muestras de pacientes con deficiencias de factores, inhibidores anti-FVIII o anti-FIX, y bajo terapia con heparina o anti-vitamina K. El grupo principal fue evaluar al AL en 1553 pacientes durante 3 años. Utilizaron Pathromtin-SL y PTT-LA, razón PTT-LA/ Pathromtin-SL y además los ensayos de dRVVT. La sensibilidad al AL del Pathromtin-SL fue de 59%, del PTT-LA fue de 82.1% y de la razón PTT-LA/ Pathromtin-SL fue de 92.3%.
El Pathromtin-SL contiene sílice como activador y FL de origen vegetal. El PTT-LA contiene sílice y cefalina. Del grupo en estudio se demostró presencia de AL en 78 de 1553 pacientes (5%). El punto de corte de la razón PTT-LA/ Pathromtin-SL establecido en 1.40 permitió detectar 6.4% (10/157) de los pacientes AL positivo, una razón >1.50 detecto el 19.9% (29/146) de los AL, una razón >2.00 detecto el 62.3% (10/16) de los AL y una razón >2.50 detecto el 100% (17/17) de los pacientes con AL positivo. En la Figura 4 se muestran la distribución de los pacientes de acuerdo con las distintas razones PTT-LA/ Pathromtin-SL. Se puede observar que la proporción de pacientes con AL positivos se incrementa cuando aumenta la razón PTT-LA/ Pathromtin-SL (p<0.001).
APTT apareados en MANLAB
Hace muchos años uno de los autores (en otra institución) utilizaba la combinación PTT-LA/CK-Prest en casos dudosos y tenía buenos resultados (datos no publicados). El motivo de usar CK-Prest surgió como idea sabiendo que es un reactivo con caolín y alta concentración de fosfatidiletanolamina. De ahí surgió la idea de usar ese reactivo de APTT como confirmatorio del PTT-LA que era nuestro reactivo sensible al AL. Por eso en Manlab hace ya 4 años probamos la combinación PTT-LA/CK-Prest (Stago) en conjunto con el dRVVT screen/confirm en la evaluación de las muestras derivadas para estudio de AL. Lamentablemente Siemens no ofrece en su porfolio un reactivo de APTT con demostrada sensibilidad al AL. Evaluamos con plasmas normales el punto de corte que establecimos en 1.30 (para la razón APTT), en el caso de la razón dRVVT screen/confirm se estableció en 1.35. En una evaluación inicial de 173 pacientes hallamos 50 que eran AL positivo (28.9%). Hubo 22 casos (44%) (con ambas razones (dRVVT y APTT) positivas, 17 (34%) con solo positiva la razón dRVVT y 11 (25%) con solo positiva la razón APTT. En la Figura 5 se puede ver la distribución de resultados positivos y negativos de acuerdo con los resultados en las razones obtenidas con dRVVT y/o APTT. En total la razón dRVVT screen/confirm fue positiva en 78% y la razón PTT-LA/CK-Prest en el 66% de los pacientes AL positivo. El rango en las muestras AL positivas de la razón PTT-LA/CK-Prest fue de 1.41-3.14. El rango en las muestras AL positivas de la razón dRVVT screen/confirm fue de 1.41-2.89.
El reactivo de CK-Prest tiene la desventaja que necesita agitación constante y en nuestros equipos automatizados no se logra con eficiencia y debíamos hacer agitación manual del reactivo cada vez que lo usábamos. Por tal motivo a fines del último año decidimos cambiar y usar el reactivo de Pathromtin-SL y actualmente usamos la razón PTT-LA/Pathromtin-SL como par de APTT para la detección y confirmación del AL. En los ensayos previos antes de realizar el cambio observamos que había muy buena
correlación con los resultados que teníamos con la razón PTT-LA/CK-Prest (datos no mostrados).
En el laboratorio también informamos el resultado en grados de positividad porque a nuestro entender es muy importante. Los AL de actividad débil tienen tendencia a negativizarse en el tiempo y además tienen menor importancia como significado clínico a futuro. Para la razón dRVVT usamos la siguiente interpretación: >1.35 positivo débil, >1.75 positivo moderado y >2.0 positivo fuerte. Para la razón APTT: >1.30 positivo débil, >1.60 positivo moderado y >1.90 positivo fuerte. Los rangos de positividad del dRVVT son similares a los propuestos por la empresa comercial en la información del reactivo, pero luego de una validación y ajuste local en el laboratorio. Para el APTT se tomó en cuenta la experiencia profesional para definir los rangos. El informe final va con el rango de positividad de la razón que dio más alto. Además, hay pacientes que dan solamente positivo solo con uno de los dos ensayos (dRVVT o APTT).
Recientemente en el Hospital Británico (servicio de Hematología) hicieron un estudio de comparación de 3 combinaciones de APTT: PTT-LA cómo reactivo sensible y 3 insensibles al AL (Pathromtin-SL, Cephascreen y CK-Prest). Utilizaron 120 plasmas normales para establecer los puntos de corte y 73 pacientes consecutivos para estudio de AL (10). En 35 de 73 pacientes los resultados fueron positivos. Establecieron los percentiles 97.5 y 99 de la distribución normal y en su coagulómetro y población evaluada, demostraron que las 3 combinaciones son útiles para el diagnóstico y la razón APTT sensible/APTT insensible representa una estrategia simple y sensible para el diagnóstico de AL por la vía del APTT, en especial cuando el punto de corte se establece como el percentil 97,5. Debe utilizarse en conjunto con la prueba dRVVT. Las razones APTT con las distintas combinaciones dieron positivas en más del 70% de los pacientes con AL positivo.
Puntos críticos
- Siempre que sea posible realizar el estudio de AL en pacientes sin terapia antitrombótica
- Suspender al menos 48hs en casos de tratamiento con DOACs o 1 semana después de cesar los anti-vitamina K
- Utilizar al menos dos pruebas de detección basados en principios de coagulación diferentes
- Establecer localmente los puntos de corte de cada ensayo incluido en el panel del AL
Conclusiones
El estudio y la interpretación del AL tiene aún al día de hoy ciertas dificultades basadas en la diversidad de reactivos comerciales con diferente sensibilidad al AL, la no utilización por parte de un grupo importante de laboratorios de las recomendaciones o guías de la ISTH, no utilizar o validar los puntos de corte en forma local, etc. Todo eso dificulta la
correcta interpretación de la presencia o ausencia del AL en las muestras en estudio. Muchos laboratorios solo realizan la prueba del dRVVT y por eso la incorporación de las APTT apareados (sensible/insensible) es muy útil porque completa lo recomendado en las guías internacionales y tiene un costo más económico dentro del panel de estudio del AL.
Referencias bibliográficas
1. Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite anti-phospholipid syndrome (APS). J Thromb Haemost 2006; 4:295-306.
2. Devreese KMJ, de Groot PG, de Laat B, et al. Guidance from the Scientific and Standardization Committee for lupus anticoagulant/antiphospholipid antibodies of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2020; 18:2828–2839.
3. Favaloro EJ, Pasalic L. Lupus anticoagulant testing during anticoagulation, including direct oral anticoagulants. Res Pract Thromb Haemost 2022; 6:e12676.
4. Forastiero RR, Cerrato GS, Carreras LO. Evaluation of recently described tests for detection of the lupus anticoagulant. Thromb Haemost 1994; 72:728-733.
5. Moore GW, Jones PO, Platton S, et al. International multicenter, multiplatform study to validate Taipan snake venom time as a lupus anticoagulant screening test with ecarin time as the confirmatory test: Communication from the ISTH SSC Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibodies. J Thromb Haemost. 2021; 19:3177-3192.
6. Brancaccio V, Ames PR, Glynn J, et al. A rapid screen for lupus anticoagulant with good discrimination from oral anticoagulants, congenital factor deficiency and heparin, is provided by comparing a sensitive and an insensitive APTT reagent. Blood Coagul Fibrinolysis 1997; 8:155-160.
7. Kumano O, Amiral J, Dunois C, et al. Paired APTTs of low and high lupus anticoagulant sensitivity permit distinction from other abnormalities and achieve good lupus anticoagulant detection rates in conjunction with dRVVT. Int J Lab Hematol 2019; 41:60–68.
8. Li R, Swaelens C, Vandermijnsbrugge B, et al. Applying a direct aPTT ratio (PlatelinLS/ActinFS) permits to identify rapidly and reliably a -related factor deficiency or a lupus anticoagulant sequential to an isolated prolongation of aPTT in paediatric pre-operative screening. Eur J Haematol 2016; 96:578-585.
9. Luginbühl R, Barizzi G, Sulzer I, et al. Screening for lupus anticoagulant: improving the performance of the lupus-sensitive PTT-LA. Int J Lab Hematol. 2011; 33:168-175.
Bertoncin A, Bossio F, Ceresetto J, et al. Desempeño de distintos pares de APTT de alta y baja sensibilidad a fosfolípidos para diagnosticar anticoagulante lúpico. Calilab 2022; LU027-4479.
