¿Qué es CH50?
El sistema del complemento es un componente crucial de nuestro sistema inmunitario innato que apoya la defensa del organismo contra lesiones e infecciones. Sus funciones incluyen la activación de la respuesta inflamatoria, la destrucción de bacterias y virus mediante fagocitosis, la aglutinación de patógenos y la lisis celular de organismos susceptibles.
Existen tres vías distintas a través de las cuales se activa la cascada del complemento, cada una desencadenada por mecanismos diferentes. Y estas vías involucran a más de 50 proteínas distintas.
La determinación de las proteínas del sistema inmunitario innato y adaptativo es un paso importante en la evaluación de la competencia inmunológica, así como en el diagnóstico de inmunodeficiencia y en la investigación de enfermedades mediadas por el sistema inmunitario que pueden ser el resultado de una desregulación de la respuesta inmunológica normal.
Inmunodeficiencia: Estado en el que la capacidad del sistema inmunitario para hacer frente a enfermedades infecciosas está comprometida o totalmente ausente.
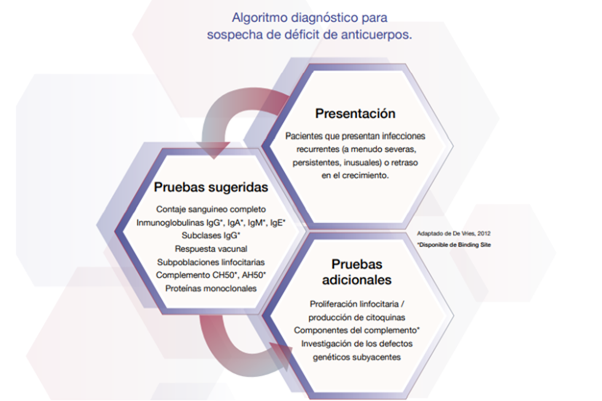
Fig. 1 El diagnóstico de inmunodeficiencia requiere de la información proporcionada por una variedad de pruebas de laboratorio junto con la presentación clínica. Las directrices para el diagnóstico están disponibles en la European Society for Immunodeficiency (ESID) y en American Academy of Allergy, Asthma and Immunology.
La mayoría de los componentes del complemento son sintetizados por hepatocitos, aunque algunos se producen por otros tipos celulares, como los monocitos, macrófagos, fibroblastos y células epiteliales del tracto gastrointestinal y genitourinario.
El sistema de complemento es una serie compleja de proteínas que actúan como cascada y en colaboración. Reaccionan en la secuencia C1q, C1r, C1s, C4, C2, C3, C5, C6, C7, C8, C9; muchos requieren de descomposición proteolítica para activarse. La cascada se activa mediante la vía clásica, la vía alternativa o la vía de la lectina. Las proteínas del complemento se analizan para medir el consumo del mismo y diagnosticar deficiencias hereditarias de los componentes individuales de la cascada.
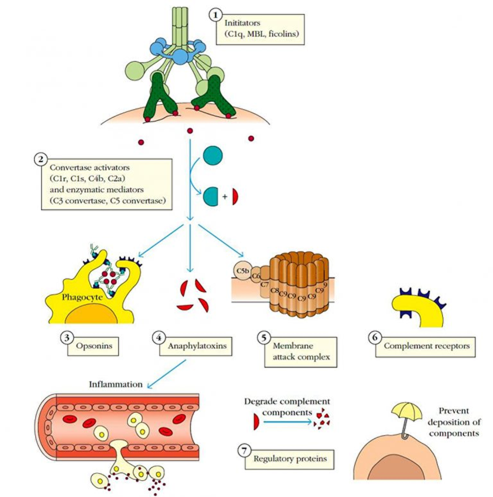
Los componentes del complemento se pueden clasificar en siete categorías funcionales:
(1) Las rutas del complemento se inician por proteínas como el C1q que se unen a patógenos o bien directamente o por anticuerpos o por proteínas específicas de patógeno.
(2) Mediadores enzimáticos que activan otras enzimas que generan proteínas centrales de la cascada del complemento, las C3 y C5 convertasas, las cuales rompen C3 y C5, liberando componentes activos que median todas las funciones del complemento, incluyendo
(3) opsonización,
(4) inflamación y
(5) la generación del complejo de ataque a la membrana (MAC).
Las proteínas efectoras del complemento pueden marcar un complejo antígeno-anticuerpo por fagocitosis (opsoninas), iniciar inflamación (anafilotoxinas) o unirse a un patógeno y formar el MAC. A menudo, estos efectores actúan a través de
(6) receptores del complemento en células fagocíticas, granulocitos o eritrocitos.
(7) Asimismo, proteínas reguladoras limitan los efectos del complemento mediante la promoción de su degradación o prevención de su unión a las células del huésped.
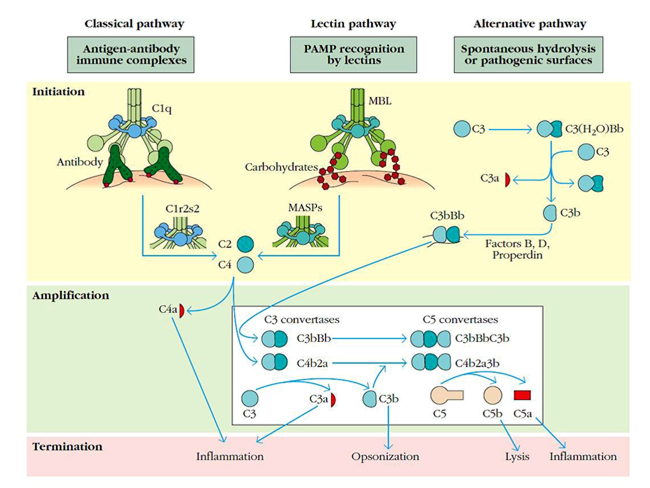
El sistema del complemento se puede activar por tres vías:
- La ruta clásica se inicia cuando C1q se une a complejos antígeno-anticuerpo. El componente enzimático C1r de C1 se activa y rompe C1s, el cual a su vez rompe C4 en C4a (una anafilotoxina) y C4b. C4b se une a la membrana y a C2, el cual se rompe por C1s para formar C2a y C2b. Así, C2a permanece unido a C4b, formando la convertasa C3 de la ruta clásica (C4b2a).
- En la ruta de las lectinas, las lectinas de unión a manosa (MBL) se unen específicamente a carbohidratos conservados en patógenos, activando serín proteasas asociadas a MBL (MASPs). Las MASPs rompen C2 y C4 generando la convertasa C3 como en la vía clásica.
- En la ruta alternativa para la activación del sistema del complemento, C3 se somete a una hidrólisis espontánea para dar C3(H2O), el cual se une al factor B del suero. En esta unión, B se rompe por el factor D y el complejo C3(H2O)Bb resultante forma la convertasa C3 en fase fluida. Algunas C3b, liberadas después de la ruptura de C3 por este complejo, se unen a la superficie de los microorganismos. Así, se une al factor B, el cual se rompe por el factor D, formando la convertasa C3 de la ruta alternativa, C3bBb. Este complejo se estabiliza por properdina.
Finalmente, las convertasas C5 se forman por la adición de un fragmento C3b para cada convertasa C3. Las C5 convertasas se rompen en C5a y C5b, mediadores inflamatorios que inician la formación del complejo de ataque a membrana, con la adición de los componentes C6, C7, C8 y C9 al componente C5b. Este complejo induce la formación de grandes poros en la membrana, alterando su integridad osmótica y provocando la muerte celular.
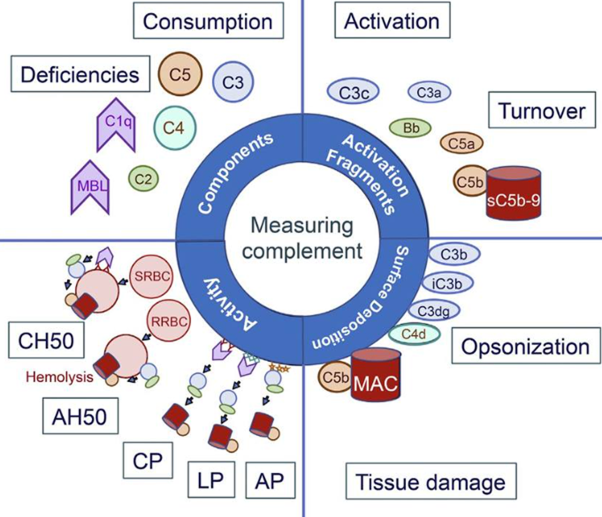
¿Cuándo se recomienda realizar la medición de CH50?
Se recomienda la medición de CH50 como parte del protocolo de diagnóstico de las inmunodeficiencias primarias, y además, puede proporcionar información importante para muchas otras enfermedades como el lupus eritematoso sistémico e infecciones bacterianas. Cuando se sospecha una deficiencia de complemento, puede ser necesario realizar un análisis de los componentes específicos del sistema de complementos.
El análisis del complemento se suele usar para diagnosticar o controlar enfermedades autoinmunes como:
- Lupus: Enfermedad crónica (de larga duración) que afecta varias partes del cuerpo, como las articulaciones, los vasos sanguíneos, los riñones y el cerebro
- Artritis reumatoide: Causa dolor e hinchazón en las articulaciones, más comúnmente en las muñecas, manos y pies
También se puede usar para diagnosticar ciertas infecciones bacterianas, virales o micóticas.
Se puede solicitar esta prueba si tiene síntomas de una enfermedad autoinmune. Dependiendo de la parte del cuerpo afectada. Los síntomas pueden aparecer y desaparecer y pueden incluir:
- Infecciones
- Inflamación sin causa aparente, como enrojecimiento, hinchazón, calor y dolor
- Fatiga
- Dolor o hinchazón de las articulaciones
- Dolor muscular
Si los resultados muestran un menor nivel o actividad de las proteínas del complemento, puede significar que el organismo está tratando de eliminar una sustancia extraña o está atacando sus propios tejidos.
Niveles más bajos pueden ser señal de:
- Lupus
- Artritis reumatoide
- Cirrosis (cicatrización del hígado)
- Ciertos tipos de enfermedad de riñón
- Angioedema hereditario. Puede causar hinchazón de la cara y las vías respiratorias.
- Desnutrición
- Infección recurrente (generalmente bacteriana)
- Variables preanalíticas por mal conservación de la muestra (Muestra no congelada)
Si sus resultados muestran un mayor nivel o actividad de las proteínas del complemento, puede significar que su cuerpo tiene inflamación aguda o crónica.
Niveles más altos pueden ser señal de:
- Ciertos tipos de cáncer, como leucemia o el linfoma no Hodgkin
- Colitis ulcerativa, una afección en la que el revestimiento del intestino grueso y el recto se inflaman
Si recibe tratamiento para lupus o una enfermedad autoinmunitaria, el aumento de los niveles o de la actividad de las proteínas del complemento puede significar que el tratamiento está dando resultado.
¿Cómo realizamos la medición de CH50?
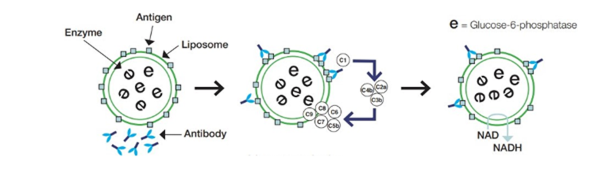
La complejidad de las interacciones de la cascada del complemento implica que la funcionalidad del MAC no necesariamente se ve inferida por niveles aparentemente normales de cada uno de los componentes del complemento. Por ello el método tradicional para determinar en suero la actividad total del complemento es el análisis CH50, basado en la hemólisis de eritrocitos sensibilizados con anticuerpos, con mediación del complemento. El ensayo de CH50 para uso en Optilite minimiza estos problemas al analizar directamente la función del MAC, y determinar así la actividad total del complemento (CH50).
Los liposomas, que contienen glucosa-6-fosfato deshidrogenasa (G6PDH) suelen mimetizar los microorganismos invasores. Al añadir la muestra, los anticuerpos del reactivo se combinan con grupos de dinitrofenil en la superficie de los liposomas. El complejo que aparece como resultado activa el complemento en la muestra, que lisa el liposoma, liberando G6PDH para reaccionar con la glucosa-6-fosfato y NAD en el reactivo. Se puede medir por turbidimetría el cambio en la absorbancia, que es proporcional a la actividad del complemento en la muestra. Al compararlo con una curva de calibración se obtiene un valor para la muestra de un paciente desconocido.
| Valor de referencia (U/mL) | |
| CH50 en suero | 41,68-95,06 |
BIBLIOGRAFÍA
1.Mayer MM. Complement and complement fixation. In Kabat EA, Mayer MM, ed. Experimental immunochemistry, 2nd ed. Springfield, IL: Charles C Thomas, 1967: 133-240.
- Pickering M. C and Walport M. J. (2000). Links between complement abnormalities and systemic lupus erythematosus. Rheumatology, 39: 133-141.
- Berger S.P and Daha M.R. (2007). Complement in glomerular injury. Semin Immunopathol, 29: 375-384.
- Wen L, Atkinson J.P and Giclas P.C. (2004). Clinical and laboratory evaluation of complement deficiency. J. Allergy Clin Immunol 113(4): 585-593.
- Yanamato S, Kubotsu K, Kida M, Kondo K, Matsuura S, Uchlyama S, Yonekawa O, Kanno T (1995). Automated homogeneous liposome-based assay system for total complement activity. Clin Chem, 41: 586-90.
- Young D. Effects of Drugs on Clinical Laboratory Tests, 5th ed. AACC Press, 2000.
7.Lung, Thomas et al. “La utilidad de los ensayos del complemento en inmunología clínica: Una revisión exhaustiva”. Revista de autoinmunidad, vol. 95 (2018): 191-200.
8.Antonis Fanouriakis et al. Ann Rheum Dis 2021;80:14-25
9.Owen JA, Punt J, Strandford SA, Jones PP. Kuby Immunology. 7th Edition (2013).
10.Reid KBM. Complement Component C1q: Historical Perspective of a Functionally Versatile, and Structurally Unusual, Serum Protein. Front Immunol 10;9:764 (2018).
11.Blom, A. M., T. Hallstrom, and K. Riesbeck, K. Complement evasion strategies of pathogens—acquisition of inhibitors and beyond. Molecular Immunology 46:2808–2817 (2009).
12.Chen G, Sequeira F, Tyan DB. Novel C1q assay reveals a clinically relevant subset of human leukocyte antigen antibodies independent of immunoglobulin G strength on single antigen beads. Hum Immunol 72:849–858 (2011).
13. Tambur AR, Herrera ND, Haarberg KM, Cusick MF, Gordon RA, Leventhal JR, et al. Assessing antibody strength: comparison of MFI, C1q, and titer information. Am J Transplant. 15:2421–30 (2015).
14.Molina J, Navas A, Aguera ML, Rodelo-Haad C, Alonso C, Rodriguez-Benot A, et al. Impact of preformed donor-specific anti-human leukocyte antigen antibody C1q-binding ability on kidney allograft outcome. Front Immunol. 8:1310 (2017).
15.Zeevi A, Lunz J, Feingold B, et al. Persistent strong anti-HLA antibody at high titer is complement binding and associated with increased risk of antibodymediated rejection in heart transplant recipients. J Heart Lung Transpl 32:98–105 (2013).
16.Hickey MJ, Valenzuela NM, Reed EF. Alloantibody generation and effector function following sensitization to human leukocyte antigen. Front Immunol. 7:30 (2016).
17.Valenzuela NM, Hickey MJ, Reed EF. Antibody subclass repertoire and graft outcome following solid organ transplantation. Front Immunol. 7:433 (2016).
18.Valenzuela NM, Schaub S. The biology of IgG subclasses and their clinical relevance to transplantation. Transplantation. 102:S7–13 (2018).
19.Navas A, Molina J, Agüera ML, Guler I, Jurado A, Rodríguez-Benot A, Alonso C, Solana R. Characterization of the C1q-Binding Ability and the IgG1-4 Subclass Profile of Preformed Anti-HLA Antibodies by Solid-Phase Assays. Front Immunol. 10:1712 (2019).

