¿Qué es C1q?
La formación de un complejo antígeno-anticuerpo induce cambios conformacionales en la porción Fc del anticuerpo. Este cambio conformacional expone un sitio de unión para el componente C1 del complemento. En suero, C1 existe como un complejo macromolecular de cinco proteínas que consiste en una molécula C1q y dos moléculas de cada una de las serín proteasas, C1r y C1s, (C1qr2s2), estabilizado por Ca2+.
La molécula C1q está compuesta por 18 cadenas polipeptídicas que se asocian para formar 6 brazos de triple hélice de colágeno, los extremos de los cuales se unen al dominio CH2 de la unión del antígeno al anticuerpo.
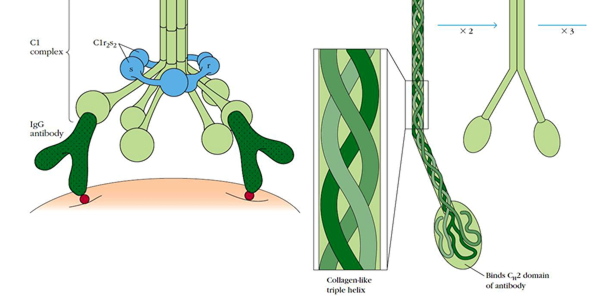
Estructura del complejo macromolecular C11
Cada complejo macromolecular debe unirse por sus cabezas globulares C1q a al menos dos sitios Fc para que se produzca una interacción estable C1-anticuerpo.
Estas cabezas globulares son similares a dominios encontrados en la superfamilia de proteínas del factor de necrosis tumoral (TNF). Además, se han asociado a C1q otras funciones relacionadas con el desarrollo de problemas del sistema nervioso central que suceden con la edad y quizá la regulación del crecimiento tumoral.
FUNCIONES DEL SISTEMA DE COMPLEMENTO
La actividad del sistema del complemento puede dividirse en tres áreas:
- Defensa innata frente a las infecciones: lisis de bacterias y membranas celulares a través del MAC, opsonización por unión covalente de C3b y C4b e inducción de inflamación y quimiotaxis por anafilotoxinas como C3a, C4a y C5a.
- Interconexión entre la inmunidad innata y adaptativa: aumentando la respuesta de los anticuerpos, favoreciendo la memoria inmunológica y la presentación antigénica. Las proteínas del complemento se unen a receptores en la superficie de las células presentadoras de antígenos, células T y B, induciendo la producción de citoquinas e interviniendo en la activación de estas células.
- Intervención en la fase de contracción de la respuesta inmune: eliminando complejos inmunes de tejidos y células apoptóticas gracias al componente C1q e inducción de células T reguladoras. La unión del componente C1q del complemento a células apoptóticas, cuerpos apoptóticos e inmunocomplejos provoca su opsonización con C3b y la subsecuente fagocitosis.
El sistema de proteínas reguladoras del complemento garantiza que la activación del complemento no se produzca en la superficie de las células huésped mediante la desactivación de los componentes del complemento en la superficie de dichas células y asegurando que las proteínas reguladoras se unan específicamente a esas células y no a la membrana de microorganismos celulares.
Virus, bacterias, hongos y parásitos han desarrollado una gran variedad de estrategias para evadir al sistema del complemento, incluyendo la mimetización con proteínas reguladoras, interferencia con las interacciones entre anticuerpo y componentes del complemento o entre proteínas de las rutas del complemento o por destrucción de sus componentes.
Relación de anticuerpos anti-HLA y C1q
Actualmente, la presencia de anticuerpos anti-HLA está asociada con un aumento de rechazo y disminución de la supervivencia de los trasplantes. Los anticuerpos se miden en ensayos semicuantitativos, donde se estratifican los resultados en función de la intensidad media de fluorescencia (MFI). Además de esto, se valoran otras propiedades como la capacidad de unión del complemento o el perfil de las subclases de IgG1-4.
Muchos artículos han mostrado que el C1q se correlaciona significativamente con un alto riesgo de rechazo mediado por anticuerpos o pérdida del injerto.
Los anticuerpos específicos de donante (DSA) C1q+ son clínicamente más relevantes que DSA IgG+. Aproximadamente el 50% de los anticuerpos IgG+ son también C1q+4, pudiendo categorizarse los anticuerpos en base a su habilidad para fijar el complemento. El ensayo C1q puede ser utilizado pre-trasplante junto con el screening de anticuerpos de rutina y post-trasplante para monitorizar la eficacia de los tratamientos de rechazo.
Se estableció que hay una relación directa entre la capacidad de unirse al sistema del complemento y la fuerza de esos anticuerpos anti-HLA5. Aunque quedan todavía aspectos por resolver, ya que anticuerpos con valores bajos de MFI (<5000) pueden unirse fuertemente a C1q y viceversa.
De entre todos los isotipos de inmunoglobulinas, IgG es considerado el principal efector del rechazo humoral a través de la activación de la vía del complemento. Sin embargo, las 4 subclases presentan diferentes propiedades, fijando el complemento en el siguiente orden: G3>G1>>G2>G4. La presencia de una mezcla de subclases es más común en anticuerpos con alta especificidad de unión a C1q y una respuesta inmune más avanzada, estimulada por una exposición a antígeno más larga y prolongada.
Pero, no está clara la asociación de la capacidad de unión al complemento con la diferente composición de subclases, ya que la proporción de IgG1/G3 es similar en anticuerpos fijadores y no fijadores de complemento.
Sin embargo, las subclases de IgG no pueden usarse en determinados casos como en el caso de pacientes desensibilizados con inmunoglobulinas intravenosas u otros fármacos basados en anticuerpos humanos, puesto que también contienen subclases de IgG. Por tanto, es muy interesante y necesario llevar a cabo el ensayo C1q para estar seguros del estado de fijación del complemento por los anticuerpos.
BIBLIOGRAFÍA
1.Zuraw B.L. (2003), Diagnosis and management of hereditary angioedema: an American approach Transfusion and Apheresis Science, 29. pp 239–245
- Rosen F.S. and Davis A.E. (2005) Deficiencies of C1 inhibitor. Best Practice & Research Clinical Gastroenterology Vol. 19, No. 2, pp. 251–261
- Gompels M. M., et al (2005) C1inhibitor deficiency: consensus document British Society for Immunology, Clinical and Experimental Immunology139:pp379–394
- Use of Anticoagulants in Diagnostic Laboratory Investigations WHO/DIL/LAB/99.1 Rev.2 2002 5. Cugno M. et al (1990), Plasma levels of C1 inhibitor complexes and cleaved C1 inhibitor in patients with hereditary angioneurotic edema. J Clin Invest 85: 1215- 1220.
- Alsenz J, Bork K, Loos M, (1987), Autoantibody-mediated acquired deficiency of C1 inhibitor. N Engl J Med 316: 1360-1366.
- Chevailler A. et al (1996). C1-inhibitor binding monoclonal immunoglobulins in three patients with acquired angioneurotic edema. J Clin Immunol 97 (4): 998-1008.
- Fremeau-Bacchi V. et al (2002). Prevalence of monoclonal gammopathy in patients presenting with acquired angioedema type 2. Am J Med 113 (3) 194-199.
- Young D. Effects of Drugs on Clinical Laboratory Tests, 5th ed. AACC Press, 2000
10.Owen JA, Punt J, Strandford SA, Jones PP. Kuby Immunology. 7th Edition (2013).
11.Reid KBM. Complement Component C1q: Historical Perspective of a Functionally Versatile, and Structurally Unusual, Serum Protein. Front Immunol 10;9:764 (2018).
12.Blom, A. M., T. Hallstrom, and K. Riesbeck, K. Complement evasion strategies of pathogens—acquisition of inhibitors and beyond. Molecular Immunology 46:2808–2817 (2009).
13.Chen G, Sequeira F, Tyan DB. Novel C1q assay reveals a clinically relevant subset of human leukocyte antigen antibodies independent of immunoglobulin G strength on single antigen beads. Hum Immunol 72:849–858 (2011).
14. Tambur AR, Herrera ND, Haarberg KM, Cusick MF, Gordon RA, Leventhal JR, et al. Assessing antibody strength: comparison of MFI, C1q, and titer information. Am J Transplant. 15:2421–30 (2015).
15.Molina J, Navas A, Aguera ML, Rodelo-Haad C, Alonso C, Rodriguez-Benot A, et al. Impact of preformed donor-specific anti-human leukocyte antigen antibody C1q-binding ability on kidney allograft outcome. Front Immunol. 8:1310 (2017).
16.Zeevi A, Lunz J, Feingold B, et al. Persistent strong anti-HLA antibody at high titer is complement binding and associated with increased risk of antibodymediated rejection in heart transplant recipients. J Heart Lung Transpl 32:98–105 (2013).
17.Hickey MJ, Valenzuela NM, Reed EF. Alloantibody generation and effector function following sensitization to human leukocyte antigen. Front Immunol. 7:30 (2016).
18.Valenzuela NM, Hickey MJ, Reed EF. Antibody subclass repertoire and graft outcome following solid organ transplantation. Front Immunol. 7:433 (2016).
19.Valenzuela NM, Schaub S. The biology of IgG subclasses and their clinical relevance to transplantation. Transplantation. 102:S7–13 (2018).
20.Navas A, Molina J, Agüera ML, Guler I, Jurado A, Rodríguez-Benot A, Alonso C, Solana R. Characterization of the C1q-Binding Ability and the IgG1-4 Subclass Profile of Preformed Anti-HLA Antibodies by Solid-Phase Assays. Front Immunol. 10:1712 (2019).

